Geistlich TauroSept®
TauroSept KAI
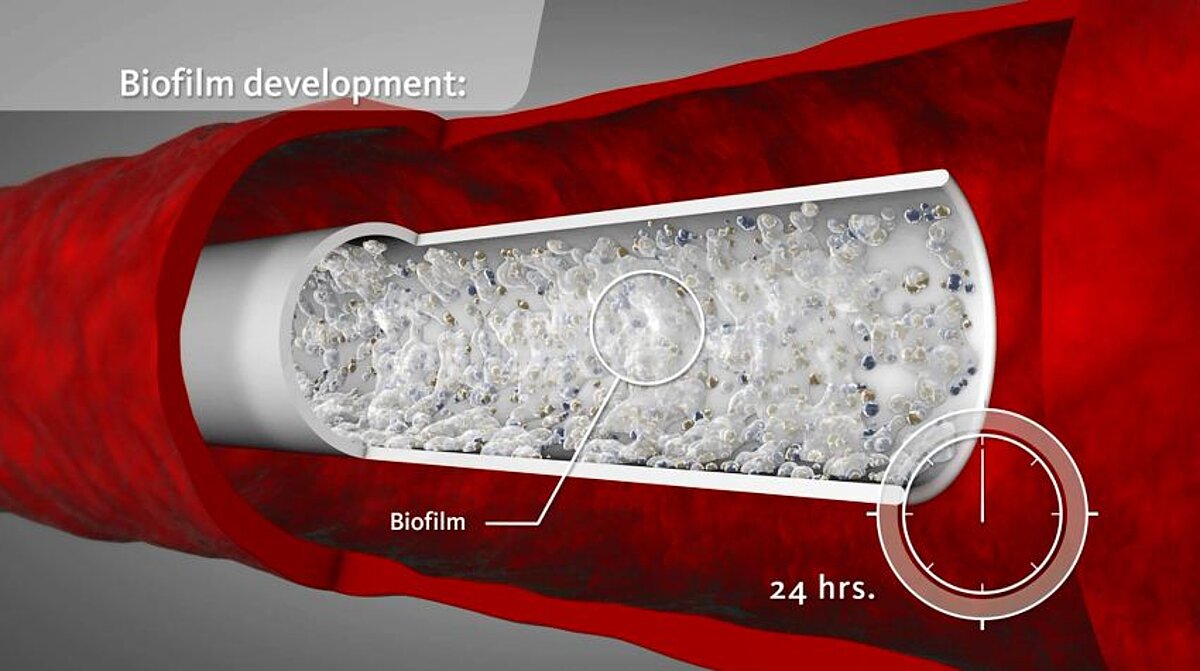
Optimale Infektionsvermeidung und -kontrolle sind bei Zentralvenenkathetern (ZVKs) unabdingbar. Doch die Inzidenz von katheter-assoziierten Infektionen (KAI) (engl. Catheter-related blood stream infections; CRBSI) liegt in Europa trotz verschiedenster Präventivmassnahmen bei 2–4,6 pro 1.000 Kathetertage. Die Mortalität einer KAI beträgt 5–25 %. (1, 2, 3) Die Gefahr einer KAI nimmt in Abhängigkeit von der Liegedauer des Katheters kontinuierlich zu. Bereits 24 Stunden nach ZVK-Anlage kann es zu einer Auskleidung des Katheters mit einem Biofilm kommen. Dieser besteht meistens aus Polysacchariden, Fibrin, Fibronektin oder Laminin und wird sowohl von Mikroorganismen als auch von körpereigenen Stoffen gebildet. (4)
Referenzen:
- Mermel, L. A. (2001). “New technologies to prevent intravascular catheter-related bloodstream
- infections.” Emerg Infect Dis 7(2): 197–9.
- Munoz, P., E. Bouza, et al. (2004). “Clinical-epidemiological characteristics and outcome
- of patients with catheter-related bloodstream infections in Europe (ESGNI-006 Study).” Clin Microbiol Infect 10(9): 843-5.
- Tacconelli, E., G. Smith, et al. (2009). “Epidemiology, medical outcomes and costs of catheter-
- related bloodstream infections in intensive care units of four European countries: literature- and registry-based estimates.” J Hosp Infect 72(2): 97–103.
- Donlan, R. M., Costerton J. W. (2002). “Biofilms: Survival mechanisms of clinically relevant
- microorganisms.” CMR.15.2.167–193.
- Bouza, E., R. San Juan, et al. (2004). “A European perspective on intravascular catheter-related
- infections: report on the microbiology workload, aetiology and antimicrobial susceptibility (ESGNI-005 Study).” Clin Microbiol Infect 10(9): 838–42.
Bakterien können über die äussere Katheteroberfläche oder durch das Lumen des Katheters in die Blutbahn eindringen. Im Biofilm sind sie gegen körpereigene Abwehrmechanismen (Phagozytose, Antikörper) und teilweise auch gegen Antibiotika geschützt. Für etwa 50–70 % aller KAI sind gram-positive Bakterien verantwortlich. In einer europäischen KAI-Prävalenzstudie waren in 71 % gram-positive, 22 % gram-negative Bakterien und 7 % Pilze nachweisbar. Die 5 häufigsten Mikroorganismen waren Koagulase-negative Staphylokokken, Staphylococcus aureus, Candida spp., Enterococcus spp. und Pseudomonas spp. (5)
Referenzen:
- Mermel, L. A. (2001). “New technologies to prevent intravascular catheter-related bloodstream
- infections.” Emerg Infect Dis 7(2): 197–9.
- Munoz, P., E. Bouza, et al. (2004). “Clinical-epidemiological characteristics and outcome
- of patients with catheter-related bloodstream infections in Europe (ESGNI-006 Study).” Clin Microbiol Infect 10(9): 843-5.
- Tacconelli, E., G. Smith, et al. (2009). “Epidemiology, medical outcomes and costs of catheter-
- related bloodstream infections in intensive care units of four European countries: literature- and registry-based estimates.” J Hosp Infect 72(2): 97–103.
- Donlan, R. M., Costerton J. W. (2002). “Biofilms: Survival mechanisms of clinically relevant
- microorganisms.” CMR.15.2.167–193.
- Bouza, E., R. San Juan, et al. (2004). “A European perspective on intravascular catheter-related
- infections: report on the microbiology workload, aetiology and antimicrobial susceptibility (ESGNI-005 Study).” Clin Microbiol Infect 10(9): 838–42.
Kundennutzen
Als beste präventive Massnahme gegen die Entstehung von KAI gilt die Einhaltung strikter Hygienevorschriften bei Anlage und Gebrauch von ZVKs.
Ergänzend dazu hat sich die Instillation von antimikrobiellen Lösungen wie Geistlich TauroSept® ins Katheterlumen («antimikrobielle Katheterlocklösung») als klinisch wirksame Massnahme erwiesen. (1, 2, 3, 4)
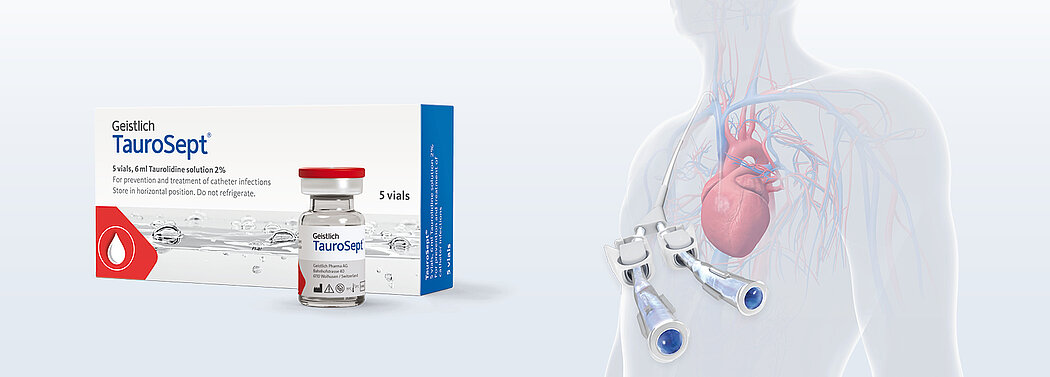
Geistlich TauroSept® ist zur Instillation in ZVKs zwischen den Behandlungen bestimmt, um das Wachstum von Bakterien und Pilzen und dadurch hervorgerufene mikrobielle Infektionen im Katheterlumen zu verhindern, die Durchgängigkeit des Lumens aufrechtzuerhalten und eine Blutgerinnung zu vermeiden.
Geistlich TauroSept® im Überblick:
- Breites bakterizides und fungizides Wirkungsspektrum
- Beugt der Bildung von Biofilmen vor
- Keine Resistenzentwicklung
- Hohe Sicherheit
Referenzen:
- Bisseling, T. M., M. C. Willems, et al. (2010). “Taurolidine lock is highly effective in preventing catheter-related bloodstream infections in patients on home parenteral nutrition: a heparin- controlled prospective trial.” Clin Nutr 29(4): 464–8.
- Jurewitsch, B. and K. N. Jeejeebhoy (2005). “Taurolidine lock: the key to prevention of recurrent catheter-related bloodstream infections.” Clin Nutr 24(3): 462–5.
- Olthof, E. D., M. W. Versleijen, et al. (2014). “Taurolidine Lock Is Superior to Heparin Lock in the Prevention of Catheter Related Bloodstream Infections and Occlusions.” PLoS One 9 (11): e111216.
- Sherertz, R. J., M. S. Boger, et al. (2006). “Comparative in vitro efficacies of various catheter lock solutions.” Antimicrob Agents Chemother 50(5): 1865–8.
Anwendung
Hinweise zur Anwendung
Befolgen Sie alle Anweisungen des Herstellers des jeweils verwendeten Katheters. Für jeden Kathetertyp werden entsprechende Kathetervolumen angegeben, die eingehalten werden müssen.
- Vor jeder Anwendung von Geistlich TauroSept® überprüfen, ob es sichtbare Partikel enthält. Wenn Partikel erkennbar sind, darf Geistlich TauroSept® nicht verwendet werden.
- Spülen Sie den Katheter mit 10 ml steriler physiologischer Kochsalzlösung, bevor sie Geistlich TauroSept® instillieren.
- Desinfizieren Sie die Oberfläche des Stopfens angebrochener Geistlich TauroSept®-Durchstechflaschen unmittelbar vor Gebrauch mit einem nicht-iodhaltigen Desinfektionsmittel. Ziehen Sie das erforderliche Volumen Geistlich TauroSept® mit einer sterilen Spritze aus der Durchstechflasche auf und füllen Sie das Katheterlumen mit Geistlich TauroSept®. Ziehen Sie die Kanüle aus dem Deckel der Durchstechflasche.
- Lassen Sie Geistlich TauroSept® mindestens 30 Minuten im Katheter einwirken. Geistlich TauroSept® kann als adjuvante Therapie für infizierte Katheter eingesetzt werden. Wenn Sie einen infizierten Katheter behandeln, lassen Sie Geistlich TauroSept® 12 Stunden lang im Katheter einwirken und wechseln es dann alle 12 Stunden gegen frische Lösung aus, bis die gewünschte Wirkung erzielt ist.
- Wenn möglich, aspirieren und entsorgen Sie bereits instilliertes Geistlich TauroSept® vor der nächsten Verwendung des Katheters. Wenn ein Abziehen von Geistlich TauroSept® aus technischen Gründen nicht möglich ist, wie beispielsweise bei vollständig implantierbaren venösen Zugangssystemen (Portkathetern), oder klinisch nicht er-wünscht ist, wie beispielsweise bei parenteraler Ernährung, kann die Spülung mit GeistlichTauroSept® ohne systemische Wirkung erfolgen.
Vorsichtsmassnahmen
Geistlich TauroSept® ist nicht zur systemischen Injektion bestimmt. Vor der nächsten Verwendung des Katheters ist die Lösung aus dem Katheter zu entfernen. Wenn ein Aspirieren der Geistlich TauroSept®-Lösung aus technischen Gründen nicht möglich ist (z. B. bei implantiertem Gefässzugangssystem/ Portkatheter) oder klinisch nicht erwünscht ist (z. B. bei parenteraler Ernährung), kann Geistlich TauroSept® ohne systemische Wirkung gespült werden.
- Geistlich TauroSept® sollte bei Patienten mit bekannten allergischen Veranlagungen und bei gleichzeitiger Behandlung mit Arzneimitteln, die erwiesenermassen eine Wechselwirkung mit Taurolidin haben, mit Vorsicht verwendet werden.
- Geistlich TauroSept® darf nicht mit Oxidationsmitteln wie Dakin-Lösung (Natriumhypochlorit), Povidonjod oder Wasserstoffperoxid gemischt werden, da es sonst zu Ameisensäure oxidiert. Das Risiko ist sehr niedrig, da diese Substanzen nicht im Katheter, sondern auf der umliegenden Haut verwendet werden.
- Geistlich TauroSept® beeinträchtigt nicht die gerinnungshemmende Wirkung von Heparin. Dies ist durch in vitro, tierexperimentelle und klinische Studien mit einer geringen Anzahl an Patienten belegt. In der klinischen Praxis wurde erfolgreich Gewebeplasminogenaktivator (r-tPA) eingesetzt, wenn eine thrombolytische Massnahme im Zusammenhang mit einer Taurolidin-haltigen Katheterlock-Lösung erforderlich war.
- Eine Einzelmenge Geistlich TauroSept®-Lösung darf nur einmal instilliert werden; aspirierte Rückstände müssen entsorgt werden.
- Wenn die Durchstechflasche beschädigt ist, darf Geistlich TauroSept® nicht verwendet werden.
Darreichungsform und Packungsgrössen
Eine Originalpackung enthält 5 Durchstechflaschen aus Glas mit 6 ml oder 10 ml Geistlich TauroSept®. Das Produkt ist steril. Der Inhalt einer Durchstechflasche ist jeweils nur für einen Patienten zu verwenden und innerhalb von 48 Stunden nach dem ersten Anstechen aufzubrauchen. Notieren Sie Uhrzeit und Datum der Erstentnahme auf dem Etikett der Durchstechflasche. Eine Resterilisierung ist nicht möglich. Nicht benötigte Mengen der Lösung und aus dem ZVK aspirierte Rückstände sind zu verwerfen. Bei beschädigter Verpackung nicht verwenden. Geöffnete Verpackungen, auf denen Uhrzeit und Datum der Erstentnahme nicht oder nicht lesbar vermerkt sind, dürfen ebenfalls nicht verwendet werden.
Wissenschaftliche Nachweise
Prävention und Therapie von Katheterinfektionen durch breite antimikrobielle Wirkung
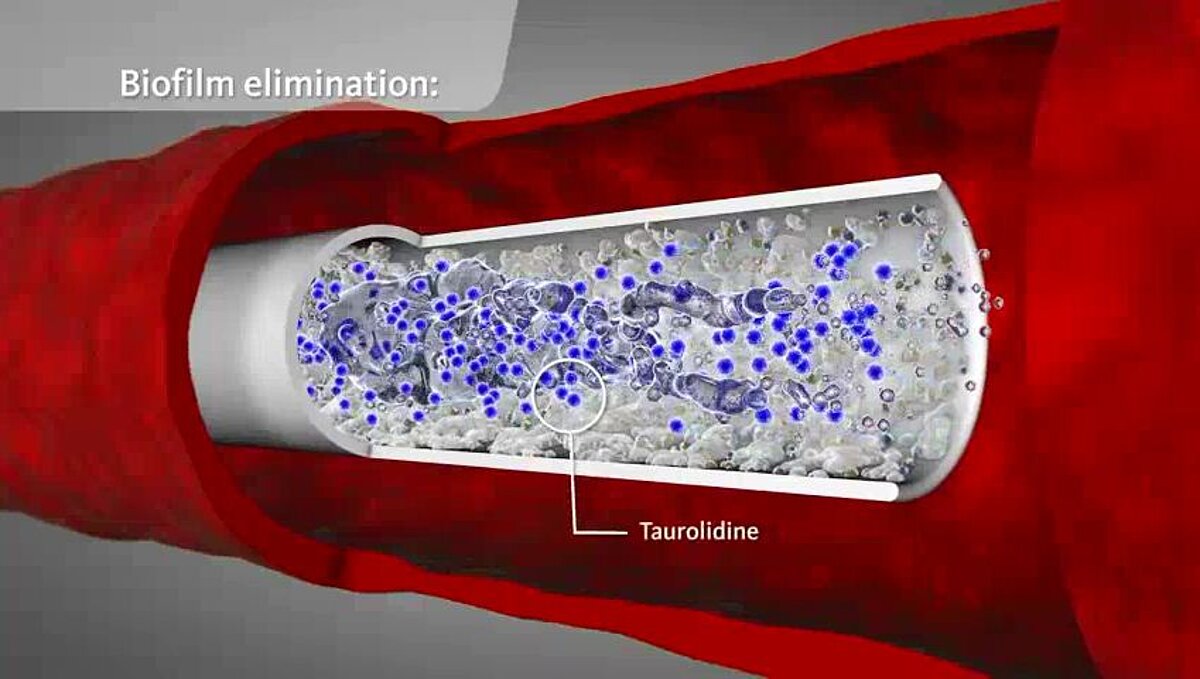
Geistlich TauroSept® enthält 2 % des antimikrobiellen Chemotherapeutikums Taurolidin. Im Gegensatz zu Antibiotika wirkt Taurolidin über eine chemische Reaktion mit mikrobiellen Zellwandstrukturen. Mikroorganismen werden dadurch abgetötet und entstehende Toxine inaktiviert. Die Abtötungszeit beträgt in vitro 15–30 Minuten. Taurolidin besitzt ein sehr breites bakterizides und fungizides Wirkungsspektrum und ist auch gegen Methicillin- und Vancomycin-resistente Bakterien (MRSA, VISA und VRE) wirksam. (1, 2, 3, 4)
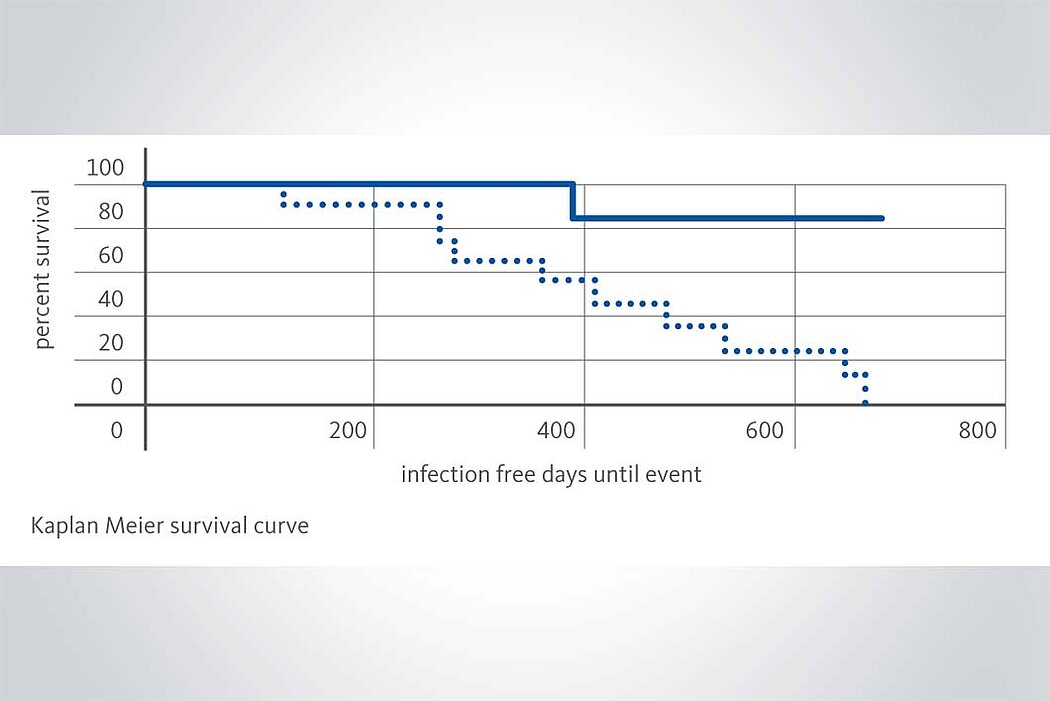
Die präventive Instillation von Geistlich TauroSept® hilft drohende ZVK-Besiedelungen zu vermeiden. (5, 6, 7) Bei schon bestehender Besiedelung kann durch Behandlung des ZVKs mit Geistlich TauroSept® in Kombination mit systemischen Antibiotika die mikrobielle Kontamination beseitigt und in vielen Fällen die Entfernung des ZVK vermieden oder lange hinausgezögert werden. (8, 9)
Verlässlichkeit in der Langzeitanwendung – keine drohende bakterielle Resistenzentwicklung
Im langjährigen klinischen Einsatz wurde bisher keine bakterielle Re-sistenzentwicklung gegen den Wirkstoff Taurolidin berichtet. Durch den besonderen Wirkungsmechanismus von Taurolidin, der auf einer Reaktion mit der Bakterienzellwand beruht, ist im Gegensatz zu Antibiotika eine Resistenzentwicklung unwahrscheinlich und nicht zu erwarten. (10, 11)
Störung der Verhindern der Biofilmentstehung durch Hemmung der bakteriellen Besiedelung
Bereits in geringen Konzentrationen bewirkt Taurolidin den Verlust der Fimbrien und Flagellen von Bakterien. Durch die Veränderung ihrer Oberfläche verlieren die Mikroorganismen ihre Fähigkeit zur Koloniebildung und die Anheftung an Oberflächen von Geweben und Biomaterialien wird verhindert. Diese antiadhäsive Eigenschaft von Taurolidin wirkt einer Biofilmbildung entgegen. (12, 13)
Förderung der intraluminalen Hämodynamik durch Reduktion lokaler pathologischer Gerinnungsprozesse
Im Gegensatz zu Heparin bewirkt Taurolidin eine zeit- und konzentrationsabhängige Hemmung der Staphylokoagulase induzierten Blutgerinnung. So verringert Taurolidin das Risiko einer pathologischen Staphylokoagulasebedingten Blutgerinnung insbesondere in der Katheterspitze. (14)
Sicherheit in der Anwendung durch ausgezeichnetete systemische Verträglichkeit
Taurolidin ist auch als pharmazeutischer Wirkstoff zur lokalen Behandlung von Infektionen wie z. B. Peritonitis zugelassen. Hierzu werden bis zu 200 ml Taurolidin 2 % täglich in die Bauchhöhle instilliert und über das Peritoneum vollständig resorbiert. Bisher sind dabei keine systemischen Nebenwirkungen beobachtet worden. Die Sicherheit des Wirkstoffs Taurolidin hat sich auch in klinischen Studien bei intravenöser Langzeitapplikation hoher Dosen (bis zu 20 g täglich) bestätigt. (15) Taurolidin wird im Organismus rasch über die ebenfalls antimikrobiell wirksamen Metabolite Taurultam und Methylol-Taurinamid zu Taurin (einer endogenen Aminosulfonsäure), CO2 und H2O verstoffwechselt. (16) Daher sind keine toxischen Effekte bekannt und im Fall einer versehentlichen Injektion nicht zu erwarten.
Referenzen:
- Olthof, E. D., R. J. Rentenaar, et al. (2013). “Absence of microbial adaptation to taurolidine in patients on home parenteral nutrition who develop catheter related bloodstream infections and use taurolidine locks.” Clin Nutr 32 (4): 538–42.
- Olthof, E. D., R. Nijland, et al. (2015). “Microbiocidal effects of various taurolidine containing catheter lock solutions.” Clin Nutr 34 (2): 309–14.
- Torres-Viera, C., C. Thauvin-Eliopoulos, et al. (2000). “Activities of taurolidine in vitro and in experimental enterococcal endocarditis.” Antimicrob Agents Chemother 44(6): 1720-4.
- Traub, W. H., B. Leonhard, et al. (1993). “Taurolidine: in vitro activity against multiple-antibiotic-resistant, nosocomially significant clinical isolates of Staphylococcus aureus, Enterococcus faecium, and diverse Enterobacteriaceae.” Chemotherapy 39(5): 322–30.
- Bisseling, T. M., M. C. Willems, et al. (2010). “Taurolidine lock is highly effective in preventing catheter-related bloodstream infections in patients on home parenteral nutrition: a heparin- controlled prospective trial.” Clin Nutr 29(4): 464–8.
- Jurewitsch, B., T. Lee, et al. (1998). “Taurolidine 2 % as an antimicrobial lock solution prevention of recurrent catheter-related bloodstream infections.” JPEN J Parenter Enteral Nutr 22(4): 242–4.
- Olthof, E. D., M. W. Versleijen, et al. (2014). “Taurolidine Lock Is Superior to Heparin Lock in the Prevention of Catheter Related Bloodstream Infections and Occlusions.” PLoS One 9 (11): e111216.
- Koldehoff, M. and J. L. Zakrzewski (2004). “Taurolidine is effective in the treatment of central venous catheter-related bloodstream infections in cancer patients.” Int J Antimicrob Agents 24(5): 491–5.
- Weber, M., F. Meyer, et al. (2009). “[Spectrum of indications and perioperative management in i. v. port-a-cath explantation-alternative administration of taurolin in case of i. v. port-a-cath infection].” Zentralbl Chir 134(4): 350–6.
- Gorman, S. P., D. F. McCafferty, et al. (1987). “Reduced adherence of micro-organisms to human mucosal epithelial cells following treatment with Taurolin, a novel antimicrobial agent.” J Appl Bacteriol 62(4): 315–20.
- Blenkharn, J. I. (1987). “The antibacterial and anti-endotoxin activity of taurolidine in combination with antibiotics.” Surg Res Comm 2: 149–155.
- Blenkharn, J. I. (1988). “Sustained anti-adherence activity of taurolidine (Taurolin) and noxythiolin (Noxyflex S) solutions.” J Pharm Pharmacol 40(7): 509–11.
- Gorman, S. P., D. F. McCafferty, et al. (1987). “Reduced adherence of micro-organisms to human mucosal epithelial cells following treatment with Taurolin, a novel antimicrobial agent.” J Appl Bacteriol 62(4): 315–20.
- Reinmuller, J. (1999). “[The influence of taurolidine on physiological and pathological blood coagulation and implications for its use].” Zentralbl Chir 124 Suppl 4: 13–8.
- Gong, L., H. E. Greenberg, et al. (2007). “The pharmacokinetics of taurolidine metabolites in healthy volunteers.” J Clin Pharmacol 47(6): 697–703.
- Knight, B. I., G. G. Skellern, et al. (1981). “The characterisation and quantitation by high- performance liquid chromatography of the metabolites of taurolin.” Br J Clin Pharmacol 12 (3): 439–40.
Qualität & Sicherheit
Sicherheit in der Anwendung durch ausgezeichnetete systemische Verträglichkeit
Taurolidin ist auch als pharmazeutischer Wirkstoff zur lokalen Behandlung von Infektionen wie z. B. Peritonitis zugelassen. Hierzu werden bis zu 200 ml Taurolidin 2 % täglich in die Bauchhöhle instilliert und über das Peritoneum vollständig resorbiert. Bisher sind dabei keine systemischen Nebenwirkungen beobachtet worden. Die Sicherheit des Wirkstoffs Taurolidin hat sich auch in klinischen Studien bei intravenöser Langzeitapplikation hoher Dosen (bis zu 20 g täglich) bestätigt. (1) Taurolidin wird im Organismus rasch über die ebenfalls antimikrobiell wirksamen Metabolite Taurultam und Methylol-Taurinamid zu Taurin (einer endogenen Aminosulfonsäure), CO2 und H2O verstoffwechselt. (2) Daher sind keine toxischen Effekte bekannt und im Fall einer versehentlichen Injektion nicht zu erwarten.
Referenzen:
- Gong, L., H. E. Greenberg, et al. (2007). “The pharmacokinetics of taurolidine metabolites in healthy volunteers.” J Clin Pharmacol 47(6): 697–703.
- Knight, B. I., G. G. Skellern, et al. (1981). “The characterisation and quantitation by high- performance liquid chromatography of the metabolites of taurolin.” Br J Clin Pharmacol 12 (3): 439–40.
Studien
Hier finden Sie die Links zu den relevanten Studien für die Nutzung von Geistlich TauroSept®. Diese Links führen zu externen Webseiten. Bitte beachten Sie, dass einige Studien nur in Verbindung mit einer Registrierung auf der jeweiligen Webseite heruntergeladen werden können.
- Activities of Taurolidine In Vitro and in Experimental Enterococcal Endocarditis
- Taurolidine: In vitro Activity against Mulitple-Antibiotic-Resistance
- Absence of microbial adaptation to taurolidine in patients on home parenteral nutrition who develop catheter related bloodstream infections and use taurolidine locks
- Taurolidine is effective in the treatment of central venous catheter-related bloodstream infections in cancer patients
- Indikationsspektrum und perioperatives Management bei i.v.-Portsystemexplantation - Alternative Taurolingabe bei i. v.-Portsysteminfektion
- The effect of taurolidine on experimental thrombus formation
- Hemmung der Staphylokokken-Koagulase durch Taurolin
- The Pharmacokinetics of Taurolidine Metabolites in Healthy Volunteers
- Taurolidine Lock is iuperior to Heparin Lock in the Prevention of Catheter Related Bloodstream Infections and Occlusions
- Incidence of central venous catheter related bloodstream infections in andults and children on home parenteral nutrition: Heparin versus Taurolidine catheter lock
- Taurolidine lock is highly effective in preventing catheter-related bloodstream infections in patients on home parenteral nutrition
- Taurolidine lock: The key to prevention of recurrent catheter-related bloodstream infections
- Randomised clinical trial: 2% taurolidine versus 0.9% saline locking in patients on home parenteral nutrition Clinical and economic impact of the taurolidine lock on home parenteral nutrition
- ESPEN guidelines on chronic intestinal failure in adults
- KRINKO Prävention von Infektionen, die von Gefäßkathetern ausgehen